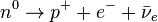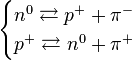Núcleo, Radioactividad, Fisión, Fusión.
El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo.
Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo (número atómico), determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento.
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Descripción del núcleo
Forma y tamaño del núcleo
A:
Donde 
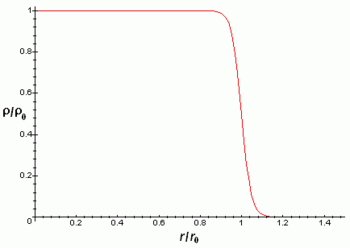
La densidad de carga eléctrica del núcleo es aproximadamente constante hasta la distancia 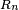 y luego decae rápidamente hasta prácticamente 0 en una distancia
y luego decae rápidamente hasta prácticamente 0 en una distancia  de acuerdo con la fórmula:
de acuerdo con la fórmula:
Donde r es la distancia radial al centro del núcleo atómico.
Las aproximaciones anteriores son mejores para núcleos esféricos, aunque la mayoría de núcleos no parecen ser esféricos como revela que posean momento cuadrupular diferente de cero. Este momento cuadrupolar se manifiesta en la estructura hiperfina de los espectros atómicos y hace que el campo eléctrico del núcleo no sea un campo coulombiano con simetría esférica.
Estabilidad del núcleo
La explicación de esta estabilidad de los núcleos reside en la existencia de los piones. Aisladamente los neutrones pueden sufrir víainteracción débil la siguiente desintegración:
Sin embargo, dentro del núcleo atómico la cercanía entre neutrones y protones hace que sean mucho más rápidas, vía interacción fuerte las reacciones:
Esto hace que continuamente los neutrones del núcleo se transformen en protones, y algunos protones en neutrones, esto hace que la reacción apenas tenga tiempo de acontecer, lo que explica que los neutrones de los núcleos atómicos sean mucho más estable que los neutrones aislados. Si el número de protones y neutrones se desequilibra, se abre la posibilidad de que en cada momento haya más neutrones y sea más fácil la ocurrencia de la reacción.
Modelos de estructura del núcleo atómico
En 1808 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia está formada por átomos indivisibles e invisibles, estos a su vez se unen para formar compuestos en proporciones enteras fijas y constantes. De hecho Dalton propuso la existencia de los átomos como una hipótesis para explicar porqué los átomos sólo se combinaban en ciertas combinaciones concretas. El estudio de esas combinaciones le llevó a poder calcular los pesos atómicos. Para Dalton la existencia del núcleo atómico era desconocida y se consideraba que no existían partes más pequeñas.
En 1897 Joseph John Thomson fue el primero en proponer un modelo estructural interno del átomo. Thomson fue el primero en identificar el electrón como partícula subatómica de carga negativa y concluyó que «si los átomos contienen partículas negativas y la materia se presenta con neutralidad de carga, entonces deben existir partículas positivas». Es así como Thomson postuló que el átomo debe ser una esfera compacta positiva en la cual se encontrarían incrustados los electrones en distintos lugares, de manera que la cantidad de carga negativa sea igual a la carga positiva.
Así ni el modelo atómico de Dalton ni el de Thomson incluían ninguna descripción del núcleo atómico. La noción de núcleo atómico surgió en 1911 cuando Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden, utilizando un haz de radiación alfa, bombardearon hojas laminadas metálicas muy delgadas, colocando una pantalla desulfuro de zinc a su alrededor, sustancia que tenía la cualidad de producir destellos con el choque de las partículas alfa incidentes. La hoja metálica fue atravesada por la mayoría de las partículas alfa incidentes; algunas de ellas siguieron en línea recta, otras fueron desviadas de su camino, y lo más sorprendente, muy pocas rebotaron contra la lámina.
A la luz de la fórmula dispersión usada por Rutherford:
Donde:
-
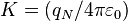 , siendo
, siendo 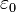 la constante dieléctrica del vacío y
la constante dieléctrica del vacío y  , es la carga eléctrica del centro dispersor.
, es la carga eléctrica del centro dispersor. -
 , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. -
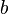 es el parámetro de impacto.
es el parámetro de impacto.
Los resultados del experimento requerían parámetros de impacto muy pequeños, y por tanto que el núcleo estuviera concentrado en la parte central, el núcleo de carga positiva, donde estaría concentrada la masa del átomo. con ello explicaba la desviación de las partículas alfa (partículas de carga positiva). Los electrones se encontrarían en una estructura externa girando en órbitas circulares muy alejadas del núcleo, lo que explicaría el paso mayoritario de las partículas alfa a través de la lámina de oro.
En 1913 Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida (por ejemplo en forma de radiación).
Comúnmente existen dos modelos diferentes describir el núcleo atómico:
- El modelo de la gota de agua
- El modelo de capas
Aunque dichos modelos son mútuamente excluyentes en sus hipótesis básicas tal como fueron formulados originalmente, A. Bohr y Mottelson construyeron un modelo mixto que combinaba fenomenológicamente características de ambos modelos.
Radiactividad
La radiactividad o radioactividad1 es un fenómeno físico por el cual losnúcleos de algunos elementos químicos, llamados radiactivos, emitenradiaciones que tienen la propiedad de impresionar placas radiográficas,ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, entre otros. Debido a esa capacidad, se les suele denominarradiaciones ionizantes (en contraste con las no ionizantes). Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de helio, electrones o positrones, protones u otras. En resumen, es un fenómeno que ocurre en los núcleos de ciertos elementos, inestables, que son capaces de transformarse, o decaer, espontáneamente, en núcleos atómicos de otros elementos más estables.
La radiactividad ioniza el medio que atraviesa. Una excepción lo constituye elneutrón, que posee carga neutra (igual carga positiva como negativa), pero ioniza la materia en forma indirecta. En las desintegraciones radiactivas se tienen varios tipos de radiación: alfa, beta, gamma y neutrones.
La radiactividad es una propiedad de los isótopos que son "inestables", es decir, que se mantienen en un estado excitado en sus capas electrónicas o nucleares, con lo que, para alcanzar su estado fundamental, deben perder energía. Lo hacen en emisiones electromagnéticas o en emisiones de partículas con una determinada energía cinética. Esto se produce variando la energía de sus electrones (emitiendo rayos X) o de sus nucleones (rayo gamma) o variando el isótopo (al emitir desde el núcleo electrones, positrones,neutrones, protones o partículas más pesadas), y en varios pasos sucesivos, con lo que un isótopo pesado puede terminar convirtiéndose en uno mucho más ligero, como el uranio que, con el transcurrir de los siglos, acaba convirtiéndose en plomo.
La radiactividad se aprovecha para la obtención de energía nuclear, se usa en medicina (radioterapia y radiodiagnóstico) y en aplicaciones industriales (medidas de espesores y densidades, entre otras).
La radiactividad puede ser:
- Natural: manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: manifestada por los radioisótopos producidos en transformaciones artificiales.
fusion nuclear
como se produce.
se produce debido la union de dos o mas nucleos ligeron en un solo nucleo la masa de esgte es menor a la suma de los primeros la parte de la materia faltante se convierte en energia.
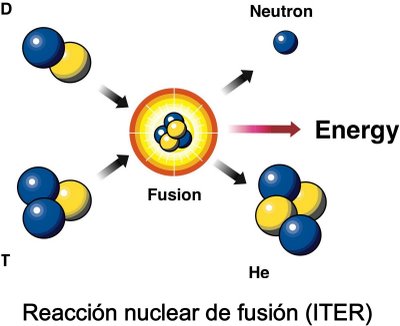
la fusion de los nucleos atomicos no se lleva a cabo con facilidad, pues por ser nucleos de carga positiva hay una naturaleza fuerza de repulsion, entre ellos para vencer esta fuerza se readvieren altas temperaturasde tal manera que una gran energia ayude a los nucleos a entrar en contacto y se produzca la fusion. las reacciones de fusion son las que mas energia pueden desprender se produce en el sol y las estrellas dodne la energia necesaria para la fusion se obtiene como resultado de la agitacion termica provocada por la temperatura de millones de grados a las caules se encuentran sometidas la materia.
fision nuclear
la fision es una reaccion nuclear esta ocurre cuadno un nucleo pesqado se divide en 2 o mas nucleos pequeños ademas de algunos subproductos como neutrones libres fotones generalmete rayos gama y otros fragmentos del nucleo como particular alfa y beta.

la fision se puede inducir por varios metodos incluyendo el bombardeo del nucleo de un atomo fisionable con una particula de la energia correcta la otra particula es generalmente un neutron libre los productos de la fision que iincluye 2 nucleos y asta siete neutrones libres ( con una medida de 2 y por raccion) y algunos fotones.

los elementos mas frecuentes usados para producir la fision nuclear son el uranio y el plutonio.
el uranio es el elemento natural mas pesado . el plutonio experiemtna dentegraciones expontaneas y tiene un periodo de vida limitado. y cuanto mas pesado es un elemento mas facil es inducir a una fision,
.